Estados Unidos
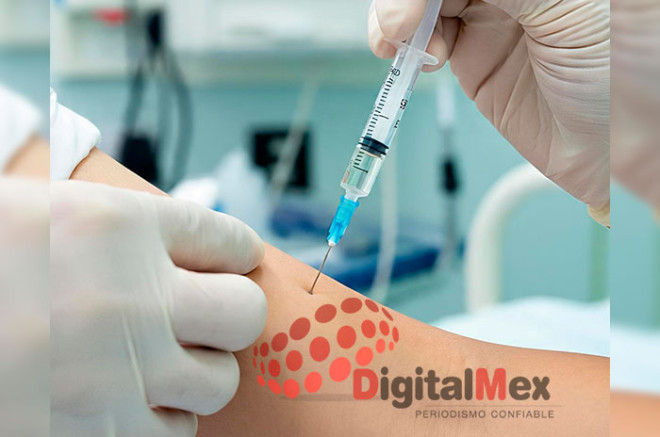
La empresa biofarmacéutica Gilead Sciences anunció este 18 de junio de 2025 que la FDA (Food and Drug Administration) aprobó “Yeztugo” (lenacapavir), el primer y único tratamiento profiláctico contra el VIH que se administra solo dos veces al año, ofreciendo seis meses de protección continua.
#CODHEM alerta sobre daños del vapeo y los beneficios inmediatos al dejarlo
El respaldo de la FDA se basó en los resultados del estudio PURPOSE 1, donde el fármaco, denominado “Yeztugo”, demostró una eficacia superior al 99 % en la prevención de infecciones entre mujeres jóvenes en África subsahariana, una de las poblaciones más vulnerables.
“Este es un día histórico en la larga lucha contra el VIH. Yeztugo podría transformar la prevención y acercarnos a acabar con esta epidemia”, declaró Daniel O’Day, CEO de Gilead.
#GileadNews: The FDA has approved our injectable HIV-1 prevention medication, making it the first and only twice-yearly #HIV prevention option in the U.S. This approval is helping to usher in the future of prevention as we work to help end the epidemic. https://t.co/wGacaduPRn pic.twitter.com/BqVToUqrtX
— Gilead Sciences (@GileadSciences) June 18, 2025
El tratamiento se administra como dos inyecciones subcutáneas en el abdomen, que forman un depósito liberado lentamente durante seis meses. Se requieren pruebas de VIH negativas antes de cada dosis. Gilead estableció el precio en Estados Unidos en 28,218 dólares anuales, anticipando que la mayoría de los seguros cubrirán el tratamiento; también ofrece programas de asistencia financiera.
A nivel global, Gilead firmó licencias sin regalías con seis fabricantes genéricos, para cubrir 120 países de ingresos bajos, con un compromiso de distribuir dosis gratuitas a dos millones de personas durante los próximos años.
#Edoméx recibe la peor evaluación nacional en sistema de salud